Daftar Pustaka Larutan Elektrolit Dan Non Elektrolit
Daftar Pustaka Larutan Elektrolit Dan Non Elektrolit - Larutan elektrolit dan non elektrolit adalah dua jenis larutan yang memiliki perbedaan signifikan dalam sifat-sifatnya. Pengertian larutan elektrolit dan non elektrolit telah membantu memahami bagaimana ion-ion berperan dalam kimia.
Apa itu Larutan Elektrolit?

Larutan elektrolit adalah larutan yang memiliki ion-ion yang dapat bergerak bebas dan dapat berpartisipasi dalam reaksi kimia. Larutan elektrolit ini dapat dibuat dengan mengencerkan suatu substansi yang dapat membentuk ion-ion dalam air.
Sifat-Sifat Larutan Elektrolit
- Daya hantarkan listrik: Larutan elektrolit memiliki daya hantarkan listrik karena ion-ionnya dapat bergerak bebas dan dapat berpartisipasi dalam reaksi kimia.
- Sifat-sifat kimia: Larutan elektrolit dapat berpartisipasi dalam reaksi kimia, seperti reaksi pembakaran, reaksi oksidasi-reduksi, dan reaksi neutralisasi.
- pH: Larutan elektrolit memiliki pH yang berbeda-beda tergantung pada jenis ion-ion yang terkandung dalam larutan.
Contoh Larutan Elektrolit
- Garam (NaCl, KCl, CaCl2)
- Asam (HCl, HNO3, H2SO4)
- Basa (NaOH, KOH, Ca(OH)2)
Apa itu Larutan Non Elektrolit?
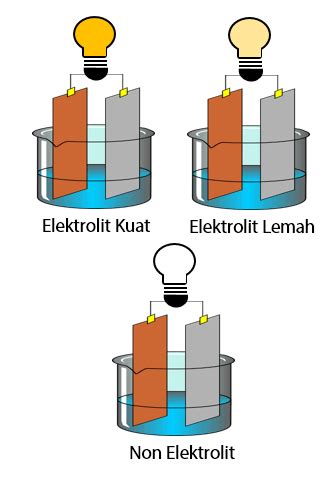
Larutan non elektrolit adalah larutan yang tidak memiliki ion-ion yang dapat bergerak bebas dan tidak dapat berpartisipasi dalam reaksi kimia. Larutan non elektrolit ini dapat dibuat dengan mengencerkan suatu substansi yang tidak dapat membentuk ion-ion dalam air.
Sifat-Sifat Larutan Non Elektrolit
- Tidak memiliki daya hantarkan listrik: Larutan non elektrolit tidak memiliki daya hantarkan listrik karena ion-ionnya tidak dapat bergerak bebas.
- Tidak berpartisipasi dalam reaksi kimia: Larutan non elektrolit tidak dapat berpartisipasi dalam reaksi kimia, seperti reaksi pembakaran, reaksi oksidasi-reduksi, dan reaksi neutralisasi.
- pH: Larutan non elektrolit memiliki pH yang stabil dan tidak berbeda-beda.
Contoh Larutan Non Elektrolit
- Gula (C6H12O6)
- Minyak (C6H5CH3)
- Cairan organik lainnya (misalnya asam bromida, etanol, dan sebagainya)
Perbedaan Antara Larutan Elektrolit dan Non Elektrolit

- Daya hantarkan listrik: Larutan elektrolit memiliki daya hantarkan listrik, sedangkan larutan non elektrolit tidak memiliki daya hantarkan listrik.
- Berpartisipasi dalam reaksi kimia: Larutan elektrolit dapat berpartisipasi dalam reaksi kimia, sedangkan larutan non elektrolit tidak dapat berpartisipasi dalam reaksi kimia.
- pH: Larutan elektrolit memiliki pH yang berbeda-beda, sedangkan larutan non elektrolit memiliki pH yang stabil.
Daftar Pustaka Larutan Elektrolit dan Non Elektrolit

Berikut adalah beberapa contoh pustaka yang dapat digunakan sebagai larutan elektrolit dan non elektrolit:
Pustaka Elektrolit
- Garam (NaCl, KCl, CaCl2)
- Asam (HCl, HNO3, H2SO4)
- Basa (NaOH, KOH, Ca(OH)2)
- Garam-garam lainnya (misalnya natrium karbonat, kalium sulfat, dan sebagainya)
- Asam-asam lainnya (misalnya asam asetat, asam format, dan sebagainya)
- Basa-basa lainnya (misalnya natrium hidroksida, kalium hidroksida, dan sebagainya)
Pustaka Non Elektrolit
- Gula (C6H12O6)
- Minyak (C6H5CH3)
- Cairan organik lainnya (misalnya asam bromida, etanol, dan sebagainya)
- Cairan non elektrolit lainnya (misalnya air, etil alkohol, dan sebagainya)
Dalam kimia, pengertian larutan elektrolit dan non elektrolit telah membantu memahami bagaimana ion-ion berperan dalam reaksi kimia. Dengan memahami perbedaan antara larutan elektrolit dan non elektrolit, kita dapat memahami bagaimana ion-ion dapat berperan dalam reaksi kimia dan bagaimana larutan-electrotik dapat digunakan sebagai bahan bakar dan catalyst dalam reaksi kimia.